上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Screen Quest 膜电位检测试剂盒 橙色荧光
 |
货号 | 36000 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 10 plates | 价格 | 6564 | |
| Ex (nm) | 535 | Em (nm) | 560 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
膜电位是细胞内外的电压差。膜电位使细胞发挥电池的作用,为各种嵌入膜内的“分子器件”提供动力。在神经元等电兴奋性细胞中,膜电位被用来在细胞的不同部位传递信号。在膜的某一点上打开或关闭离子通道会使膜电位发生局部变化,从而使电流迅速流向膜的其他点。离子通道已被确定为重要的药物发现靶点。我们的Screen Quest 膜电位检测试剂盒是一种具有快速读取的均相检测方法。它使用我们专有的长波长膜电位指示剂检测由离子通道的打开和关闭引起的膜电位变化。试剂盒中使用的膜电位指示剂的红色荧光增强了进入细胞的荧光,并将筛选化合物和细胞自身荧光造成的干扰降至最低。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Screen Quest 膜电位检测试剂盒。
适用仪器
| 荧光酶标仪 | |
| 激发: | 530nm |
| 发射: | 570nm |
| cutoff: | 550nm |
| 推荐孔板: | 黑色透明 |
| 读取模式: | 底读模式 |
| 其他仪器 |
| FDSS, FLIPR, NOVOStar, FlexStation |
产品说明书
样品实验方案
简要概述
- 在生长培养基中准备细胞
- 添加MP染料工作液
- 在室温下孵育30至60分钟
- 检测添加膜电位后化合物的荧光变化
溶液配制
储备溶液配制
1.分析缓冲液原液(1X):将1 mL的10X分析缓冲液(组分B)添加到9 mL的HHBS中(组分C,不包括#36001),并充分混合。 注意:10 mL的1X分析缓冲液足以用于1个板。
工作溶液配制
将15 uL的MP Sensor(组分A)添加到10 mL的1X 分析缓冲液储备溶液中并充分混合。 该工作溶液在室温下稳定至少两个小时。
实验步骤
1.将100 µL /孔(96孔板)或25 µL /孔(384孔板)MP染料工作溶液添加到细胞板中。注意:如果您的筛选化合物干扰了生长培养基和血清因子,那么在添加MP染料工作溶液之前,用等体积的HHBS缓冲液替换生长培养基。或者,细胞可以在无血清条件下生长。注意:上色后请勿清洗细胞。
2.在细胞培养箱中孵育工作溶液板30分钟。注意:在某些情况下,在室温下孵育30至60分钟可能会更好。
3.通过使用HHBS或所需的缓冲液来准备复合板。
4.在加入化合物的前后,使用荧光酶标仪中的内置液体处理器,通过检测Ex / Em = 530/570 nm处的荧光来运行膜电势测定。注意:在实验之前进行信号测试非常重要,不同的仪器具有各自的强度范围。将信号测试强度调整为最大仪器强度计数的10%到15%。例如,FLIPR-384的最大荧光强度计数为65,000,因此应调整仪器设置,使其信号测试强度约为7,000至10,000。
图示
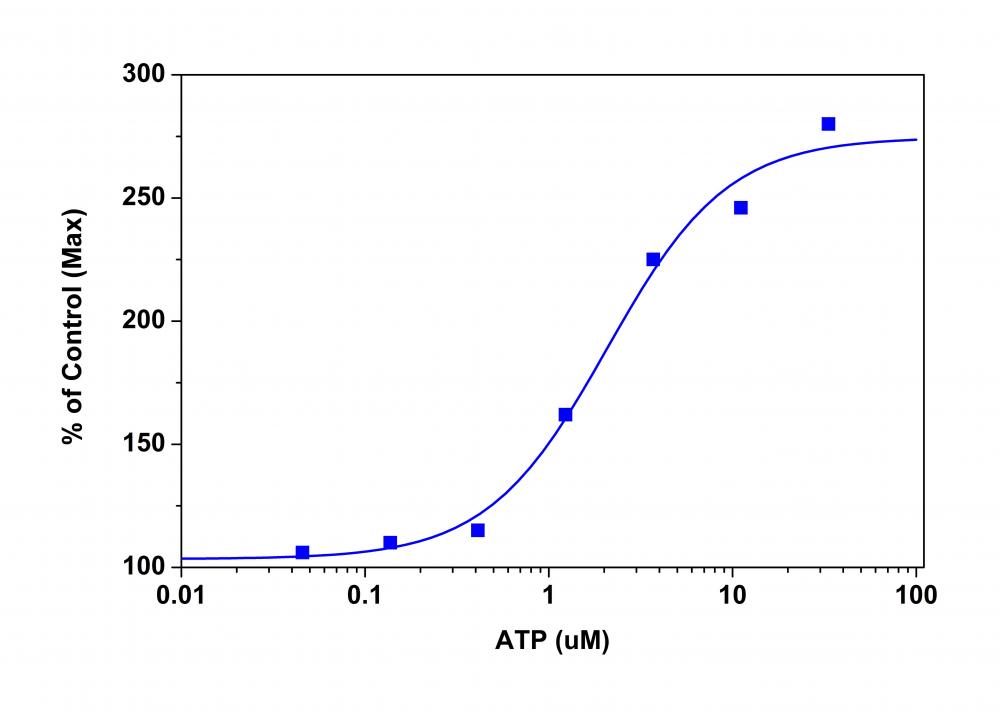
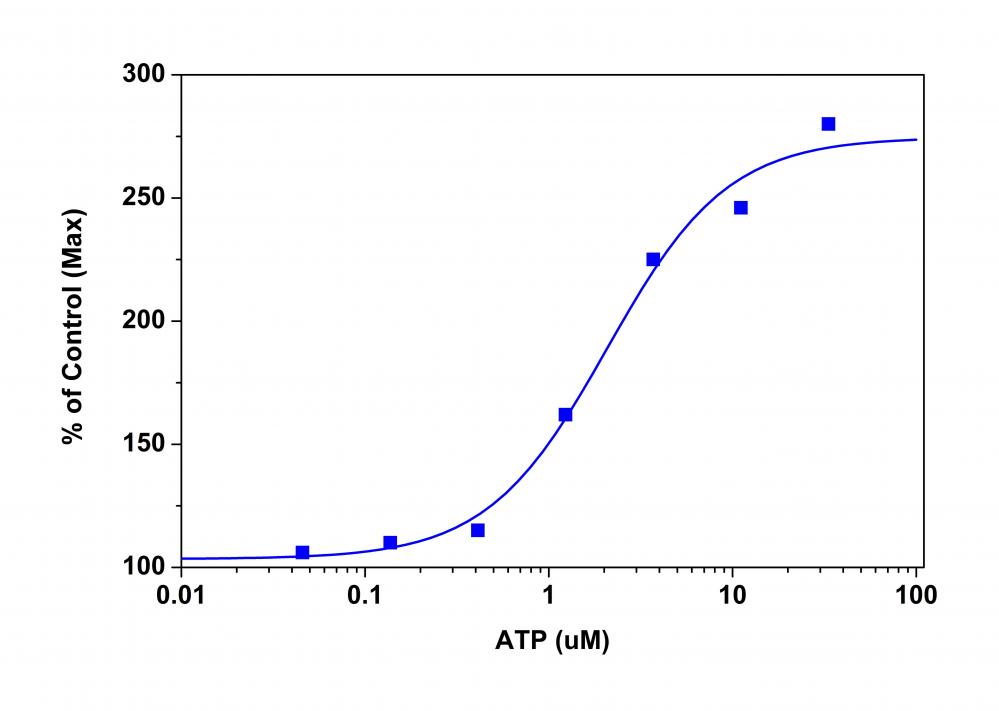 图1.用P2X受体瞬时转染的HEK细胞中的ATP剂量反应。 用P2X受体瞬时转染的HEK细胞以40,000个细胞/ 100 µL /孔的速度在Costar黑墙/透明底部96孔板中过夜接种。 将细胞与100 µL MP染料上载溶液在5%CO2、37°C的培养箱中孵育60分钟。 FlexStation添加了ATP(50 µL /孔)以达到最终指示的浓度。 用底部读取模式在Ex / Em = 530/570 nm(在550 nm处截止)下测量荧光信号。 |
参考文献
A novel high-throughput screening assay for HCN channel blocker using membrane potential-sensitive dye and FLIPR
Authors: Vasilyev DV, Shan QJ, Lee YT, Soloveva V, Nawoschik SP, Kaftan EJ, Dunlop J, Mayer SC, Bowlby MR.
Journal: J Biomol Screen (2009): 1119
A high-capacity membrane potential FRET-based assay for the sodium-coupled glucose co-transporter SGLT1
Authors: Weinglass AB, Swensen AM, Liu J, Schmalhofer W, Thomas A, Williams B, Ross L, Hashizume K, Kohler M, Kaczorowski GJ, Garcia ML.
Journal: Assay Drug Dev Technol (2008): 255
Miniaturization and HTS of a FRET-based membrane potential assay for K(ir) channel inhibitors
Authors: Solly K, Cassaday J, Felix JP, Garcia ML, Ferrer M, Strulovici B, Kiss L.
Journal: Assay Drug Dev Technol (2008): 225
A quantitative evaluation of peroxidase inhibitors for tyramide signal amplification mediated cytochemistry and histochemistry
Authors: Liu G, Amin S, Okuhama NN, Liao G, Mingle LA.
Journal: Histochem Cell Biol (2006): 283
Validation of a fluorescent imaging plate reader membrane potential assay for high-throughput screening of glycine transporter modulators
Authors: Benjamin ER, Skelton J, Hanway D, Olanrewaju S, Pruthi F, Ilyin VI, Lavery D, Victory SF, Valenzano KJ.
Journal: J Biomol Screen (2005): 365
Functional assay of voltage-gated sodium channels using membrane potential-sensitive dyes
Authors: Felix JP, Williams BS, Priest BT, Brochu RM, Dick IE, Warren VA, Yan L, Slaughter RS, Kaczorowski GJ, Smith MM, Garcia ML.
Journal: Assay Drug Dev Technol (2004): 260
Functional characterisation of the human alpha1 glycine receptor in a fluorescence-based membrane potential assay
Authors: Jensen AA, Kristiansen U.
Journal: Biochem Pharmacol (2004): 1789
Pharmacological characterization of human excitatory amino acid transporters EAAT1, EAAT2 and EAAT3 in a fluorescence-based membrane potential assay
Authors: Jensen AA, Brauner-Osborne H.
Journal: Biochem Pharmacol (2004): 2115
A rapid assay for the brevetoxin group of sodium channel activators based on fluorescence monitoring of synaptoneurosomal membrane potential
Authors: David LS, Plakas SM, El Said KR, Jester EL, Dickey RW, Nicholson RA.
Journal: Toxicon (2003): 191
Membrane potential fluorescence: a rapid and highly sensitive assay for nicotinic receptor channel function
Authors: Fitch RW, Xiao Y, Kellar KJ, Daly JW.
Journal: Proc Natl Acad Sci U S A (2003): 4909
