上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
Screen Quest 免洗Rhod-4钙检测试剂盒
 |
货号 | 36333 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 1 Plate | 价格 | 2604 | |
| Ex (nm) | 523 | Em (nm) | 551 | |
| 分子量 | 溶剂 | |||
| 产品详细介绍 | ||||
简要概述
钙通量测定法是药物发现中筛选G蛋白偶联受体(GPCR)的首选方法。 Screen Quest Rhod-4 NW钙含量测定试剂盒提供了一种基于荧光的均相测定,用于检测细胞内钙的迁移。Rhod-4是可用于HTS筛选的最亮的红色钙指示剂。一旦进入细胞内,Rhod-4 的亲脂性封闭基团就会被非特异性细胞酯酶裂解,产生带负电荷的荧光染料,并留在细胞内部,并且与钙结合后其荧光会大大增强。当细胞被筛选化合物刺激时,受体信号释放细胞内钙,这大大增加了Rhod-4的荧光。 Rhod-4 具有长波长,高灵敏度和大于250倍的荧光增强特性(当与钙形成复合物时),使其成为测量细胞钙的理想指标。此Screen Quest Rhod-4 NW钙测定试剂盒提供了一种优化的测定方法,用于检测G蛋白偶联受体(GPCR)和钙通道。该测定可以用96孔或384孔微孔板进行,并易于适应自动化。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的Screen Quest 免洗Rhod-4钙检测试剂盒。
点击查看光谱
适用仪器
| 荧光酶标仪 | |
| 激发: | 540nm |
| 发射: | 590nm |
| cutoff: | 570nm |
| 推荐孔板: | 黑色透明 |
| 读取模式: | 底读模式 |
| 其他可用仪器: |
| FDSS, FLIPR, ViewLux, NOVOStar, ArrayScan, FlexStation, IN Cell Analyzer |
产品说明书
样品实验方案
简要概述
- 准备细胞
- 除去生长培养基
- 添加Rhod-4 NW染料加载溶液(对于96孔板为100 µL /孔,对于384孔板为25 µL /孔)
- 在室温下孵育1小时
- 检测Ex / Em = 540/590 nm的荧光强度
溶液配制
储备溶液配制
1. Rhod-4 NW储备溶液:将100 µL DMSO加入小瓶Rhod-4 NW(组分A)中并充分混合,避光。 注意:10 µL Rhod-4 NW储备液足以装满一块板。
2.分析缓冲液(1X):a)对于#36330(1个板试剂盒)和#363331(10个板试剂盒),通过将9 mL HHBS(组分C)添加到10XPluronic®F127 Plus(1 mL,组分B)中来制成1X分析缓冲液,并充分混合。b)对于#36332(100板试剂盒),通过向10XPluronic®F127 Plus(10 mL,组分B)中加入90 mL HHBS(未包括)制成1X Assay Buffer。 注意:10 mL 1X分析缓冲液足以用于一块板。 分装并在<-20℃下存储未使用的1X分析缓冲液。 避光并避免重复的冻融循环。
工作溶液配制
Rhod-4 NW工作溶液:将20 µL Rhod-4 NW储备溶液加入10 mL 1X分析缓冲液中,并充分混合。 注意:该工作溶液在室温下至少可稳定2小时。
实验步骤
1.将100 µL /孔(96孔板)或25 µL /孔(384孔板)的Rhod-4 NW染料加载溶液添加到细胞板中。
2.在细胞培养箱中将染料加载板孵育30分钟,然后在室温下再孵育30分钟。 注意:如果测定需要37℃,请立即进行实验,而无需进一步室温孵育。 注意:如果细胞在室温下能长时间正常工作,请在室温下孵育细胞板1-2小时。
3.准备并添加HHBS或所需缓冲液的复合板。
4.通过检测Ex / Em = 540/590 nm的荧光强度运行钙通量检测。
图示
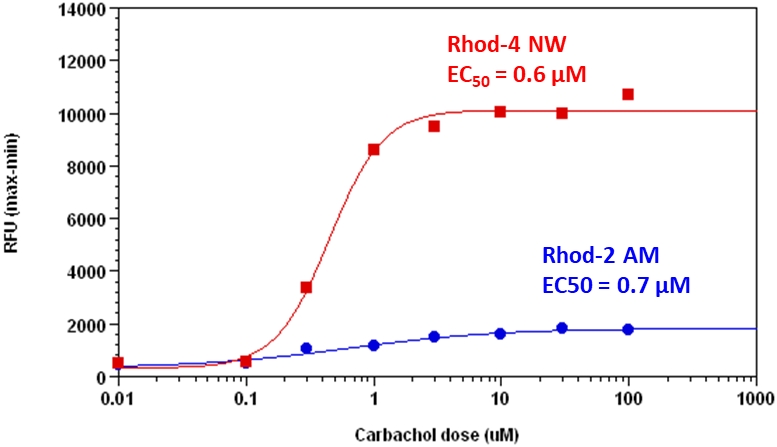 图1.使用Screen Quest Rhod-4 NW分析试剂盒和Rhod-2 AM在HEK-293细胞中测量了卡巴胆碱剂量反应。 将HEK-293细胞以40,000个细胞/ 100 µL /孔在Costar黑色96孔板中过夜接种。 使用Screen Quest™Rhod-4 NW钙测定试剂盒或100 µL Rhod-2 AM溶液(5 µM)在室温下将细胞与100 µL染料上样溶液孵育1小时。 NOVOstar(BMG Labtech)添加了卡巴胆碱(25µL /孔)以达到最终指示的浓度。 使用Rhod-4 NW的卡巴胆碱的EC50约为0.6 µM。 |
参考文献
Fluorescence absorbance inner-filter decomposition: the role of emission shape on estimates of free Ca(2+) using Rhod-2
Authors: Territo PR, Heil J, Bose S, Evans FJ, Balaban RS.
Journal: Appl Spectrosc (2007): 138
Kinetic characterization of novel NR2B antagonists using fluorescence detection of calcium flux
Authors: Bednar B, Cunningham ME, Kiss L, Cheng G, McCauley JA, Liverton NJ, Koblan KS.
Journal: J Neurosci Methods (2004): 247
Novel fluo-4 analogs for fluorescent calcium measurements
Authors: Martin VV, Beierlein M, Morgan JL, Rothe A, Gee KR.
Journal: Cell Calcium (2004): 509
Protein kinase C and myocardial calcium handling during ischemia and reperfusion: lessons learned using Rhod-2 spectrofluorometry
Authors: Stamm C, del Nido PJ.
Journal: Thorac Cardiovasc Surg (2004): 127
Cytosolic calcium in the ischemic rabbit heart: assessment by pH- and temperature-adjusted rhod-2 spectrofluorometry
Authors: Stamm C, Friehs I, Choi YH, Zurakowski D, McGowan FX, del Nido PJ.
Journal: Cardiovasc Res (2003): 695
Calcium measurements in perfused mouse heart: quantitating fluorescence and absorbance of Rhod-2 by application of photon migration theory
Authors: Du C, MacGowan GA, Farkas DL, Koretsky AP.
Journal: Biophys J (2001): 549
Calibration of the calcium dissociation constant of Rhod(2)in the perfused mouse heart using manganese quenching
Authors: Du C, MacGowan GA, Farkas DL, Koretsky AP.
Journal: Cell Calcium (2001): 217
Changes in mitochondrial Ca2+ detected with Rhod-2 in single frog and mouse skeletal muscle fibres during and after repeated tetanic contractions
Authors: Lannergren J, Westerblad H, Bruton JD.
Journal: J Muscle Res Cell Motil (2001): 265
Rhod-2 based measurements of intracellular calcium in the perfused mouse heart: cellular and subcellular localization and response to positive inotropy
Authors: MacGowan GA, Du C, Glonty V, Suhan JP, Koretsky AP, Farkas DL.
Journal: J Biomed Opt (2001): 23
Mitochondrial free calcium levels (Rhod-2 fluorescence) and ultrastructural alterations in neuronally differentiated PC12 cells during ceramide-dependent cell death
Authors: Muriel MP, Lambeng N, Darios F, Michel PP, Hirsch EC, Agid Y, Ruberg M.
Journal: J Comp Neurol (2000): 297
